近日,我校工学院顾月清/李斯文团队在权威期刊Advanced Materials (IF=27.4),学科顶尖期刊Nano Letters (IF=9.6)相继发表系列细胞外囊泡治疗衰老相关疾病的研究成果。
阿尔茨海默病(Alzheimer’s disease, AD)是一种常见的神经退行性疾病,目前缺乏可有效延缓或阻止其病程进展的治疗手段。近年来,神经激活型光遗传技术因能够“重启”退行性神经元、促进神经递质释放以及加速突触重塑,为多种神经退行性疾病的治疗带来了新的希望。然而,光遗传技术在临床应用过程中面临着持续有创和难以长期维持疗效等问题,显著阻碍了光遗传技术向临床应用的进程。
针对上述瓶颈,该研究团队提出一种即利用分化干细胞产生功能性材料以增强光遗传治疗的可应用性的新策略。通过分化诱导多能干细胞(iPSCs),获得了具有“触手状”形态的干细胞(TenSCs),并从中分离出其衍生的“触手”囊泡TenSCev。这些囊泡继承了亲本细胞的生物功能,具有出色的神经靶向能力与病理环境修复潜能。基于此,研究团队将TenSCev作为功能性载体用于递送光遗传学元件,从而实现了真正意义上的无创、可控的神经元激活。同时,TenSCev中丰富的病理环境修复物质还显著改善了局部神经环境,有效阻止了疾病进程,提升了AD模型小鼠及老龄鼠的认知功能表现。总的来说,本研究所提出的“从分化干细胞生成特异功能性生物材料”概念,使得多项神经调控技术在神经系统疾病治疗中重新展现应用潜力,具有可观的转化潜能。相关成果以题为“Noninvasive optogenetics realized by iPSC-derived tentacled carrier in Alzheimer's disease treatment”发表在权威期刊Advanced Materials (IF=27.4),工学院顾月清教授和李斯文教授为本文的共同通讯作者,2022级博士研究生翟悦雯和2021级硕士研究生时世昊为本文的共同第一作者,中国药科大学为论文第一通讯单位。
间充质干细胞外泌体在抗皮肤衰老领域展现出巨大的应用潜力,然而,如何增强外泌体的透皮效果以及如何有效控制透皮深度,仍是一项巨大的挑战。外泌体需要有效递送至真皮层才能改善胶原再生情况,减少皱纹,松弛等老化表现,从而更好的发挥抗衰老作用。现有的外泌体应用方式大多依赖有创手段如水光针和微针注射,这些方法操作复杂、技术要求高,且可能带来安全风险。因此,如何通过无损方式将外泌体高效递送至真皮层,成为当前亟待解决的技术难题。
该团队开发了一种无创、光控、具有强组织穿透能力的外泌体透皮系统。该纳米系统以外泌体为核心,以靶向真皮层过度表达的基质金属蛋白酶1(MMP1)的siRNA为外壳,形成了具有立体结构的外泌体球形核酸(ESNA),增加了组织穿透能力。进一步将可见光响应的产气分子不对称修饰在ESNA的表面,形成基于外泌体的球形核酸纳米马达 (NM-ESNA),光照下产生气体梯度作为驱动力,赋予NM-ESNA优异的光控运动性能和透皮性能。相关成果以题为“Light-controlled small extracellular vesicle-based spherical nucleic acid nanomotor for enhanced transdermal delivery against skin aging”发表在学科顶尖期刊Nano Letters,工学院李斯文教授为本文通讯作者,2021级博士研究生李钰为本文第一作者,中国药科大学为唯一通讯单位。
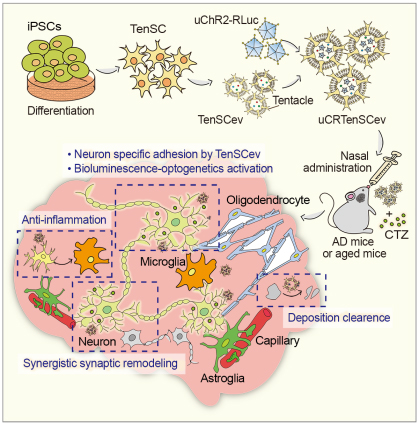
图1 “触手”囊泡协助光遗传治疗AD的示意图
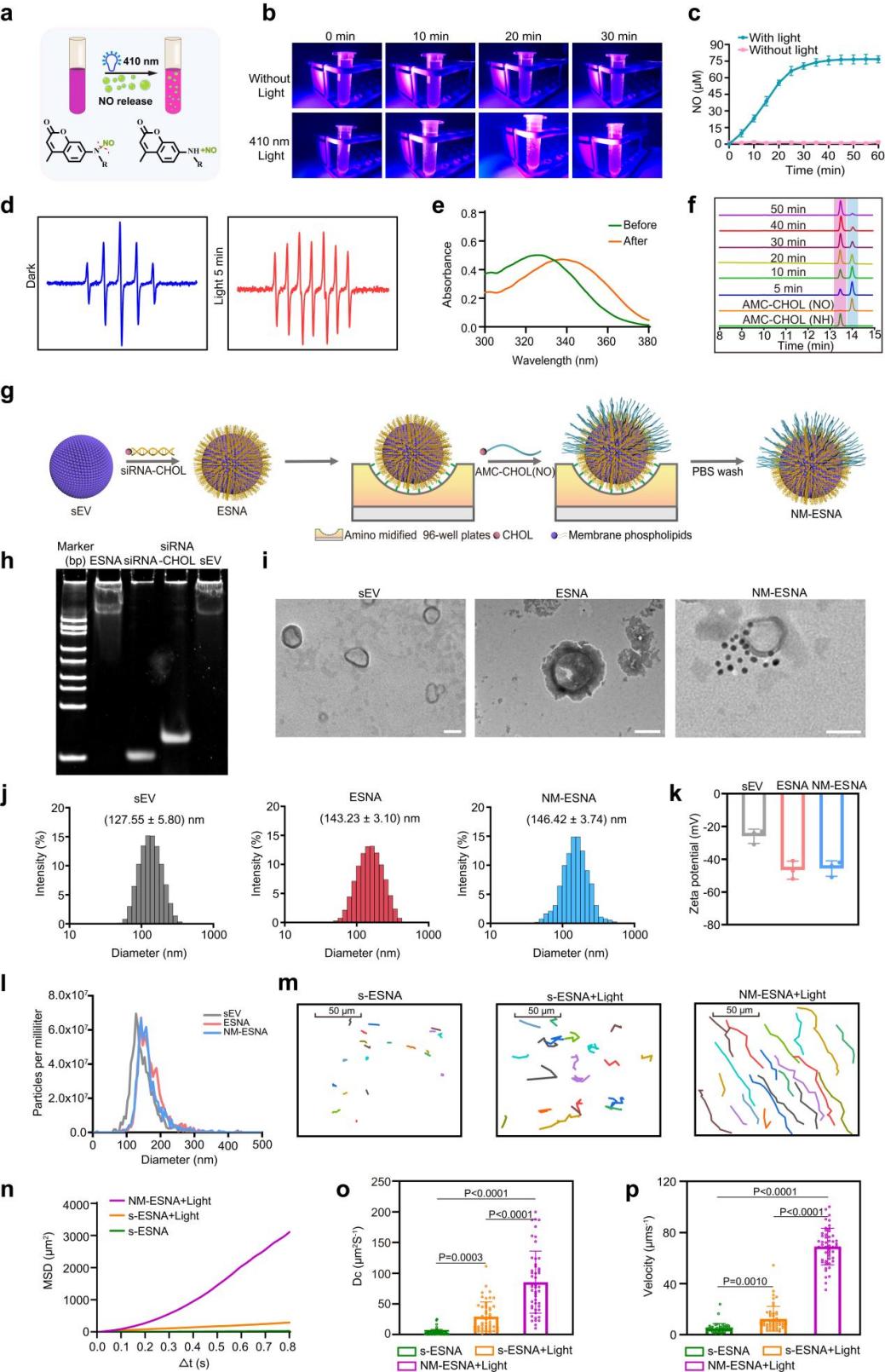
图2 NM-ESNA的构建及表征
上述工作得到了国家自然科学基金优秀青年项目、面上项目、国家重大仪器研制项目的支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.5c01747;
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202419768
(供稿单位:工学院生物医学工程与诊断药学系)

